Chemie 11 – Atombau 2
Zusammenschau und Ausblick
Die Elementarteilchen
Wir haben nun die 3 Bestandteile der Atome kennengelernt, die Elementarteilchen:
Die Protonen und Neutronen bilden den Atomkern, in dem (fast) die ganze Masse des Atoms konzentriert ist, die Elektronen bilden die Hülle. Diese besteht selbst wieder aus Schalen. Die Anzahl der Schalen entspricht der Zeile des Periodensystems: Atome in der 4. Zeile (Periode) haben 4 Schalen.
Ein Beispiel
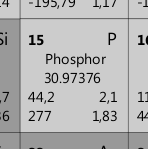
Nehmen wir beispielsweise das Element „Phosphor„. Wir finden es in der 3. Zeile des Periodensystems. Es hat die Ordnungszahl O=15 und das Symbol P. Die Massenzahl 30,97376 u wird auf eine ganze Zahl gerundet: m = 31 u.
Daraus ergeben sich folgende Informationen:
| P | Anzahl | Berechnung |
| Protonen | 15 | O |
| Elektronen | 15 | O; muss gleich der Protonenzahl sein (warum ?) |
| Neutronen | 16 | m – O = 31 – 15 = 16 (der Rest) |
| Schalen | 3 | |
| Elektronen der 1. Schale | 2 | max. 2 – wir füllen von innen nach außen auf |
| Elektronen der 2. Schale | 8 | max. 8 |
| Elektronen der 3. Schale | 5 | max. 18 – wir haben aber nur noch 5es bleiben noch 5 |
Damit sieht das Ganze dann so aus:

Wertigkeit
Die wichtigste Wertigkeit eines Atomes ergibt sich
- aus der Anzahl der Elektronen der äußersten Schale (Außenelektronen) oder
- aber aus 8 – der Anzahl der Außenelektronen
Beispiele:
- Natrium Na hat 1 Außenelektron und ist I-wertig
- Aluminium Al hat 3 Außenelektronen und ist III-wertig
- Sauerstoff O hat 6 Außenelektronen und ist II-wertig (8-6=2)
- Chlor Cl hat 7 Außenelektronen und ist I-wertig (8-7=1)
Besonderheiten
Die folgenden Ausnahmen werden aus der Struktur des Periodensystems abgeleitet:
Außenschale
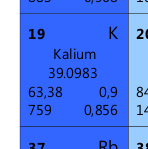
Die Außenschale eines Atoms hat HÖCHSTENS 8 Elektronen. Beispiel: Kalium K befindet sich in der 4. Zeile des PSE, O=19, m=39
| K | Anzahl | Berechnung |
| Protonen | 19 | O |
| Elektronen | 19 | O |
| Neutronen | 20 | m – O |
| Schalen | 4 | |
| Elektronen der 1. Schale | 2 | max. 2 – wir füllen von innen nach außen auf |
| Elektronen der 2. Schale | 8 | max. 8 – insgesamt 2 + 8 verteilt; es bleiben noch 5 |
| Elektronen der 3. Schale | 8 | max. 18 – diese Schale könnte das verbleibende Elektron leicht aufnehmen Dann hätte die Außenschale jedoch 9 Elektronen (was gegen diese Zusatzregel verstößt). |
| Elektronen der 4. Schale | 1 | Es wird – obwohl die 3. Schale noch nicht fertig ist, eine neue Schale begonnen |
Stabile Zwischenzustände
Die Zahlen 2 – 8 – 18 – 32 – … – 2n² stellen „stabile Zwischenzustände“ dar:
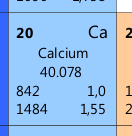
Was damit gemeint ist, erklärt sich beim nächsten Element: Calcium Ca
| Ca | Anzahl | Berechnung |
| Protonen | 20 | O |
| Elektronen | 20 | O |
| Neutronen | 20 | m – O |
| Schalen | 4 | |
| Elektronen der 1. Schale | 2 | max. 2 – wir füllen von innen nach außen auf |
| Elektronen der 2. Schale | 8 | max. 8 – insgesamt 2 + 8 verteilt; es bleiben noch 5 |
| Elektronen der 3. Schale | 8 | max. 18 – man könnte nun erwarten, dass das 20. Elektron in der 3. Schale eingebaut wird, da diese noch nicht voll ist. Aber das passiert offensichtlich nicht: |
| Elektronen der 4. Schale | 2 | max. 32 – mit 2 Elektronen in der Außenschale wird ein „stabiler Zwischenzustand“ erreicht. |

Erst bei dem nächsten Element Scandium Sc wird in der 3. Schale weitergebaut:
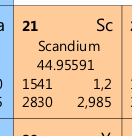
| Sc | Anzahl | Berechnung |
| Protonen | 21 | O |
| Elektronen | 21 | O |
| Neutronen | 24 | m – O |
| Schalen | 4 | |
| Elektronen der 1. Schale | 2 | max. 2 – wir füllen von innen nach außen auf |
| Elektronen der 2. Schale | 8 | max. 8 – insgesamt 2 + 8 verteilt; es bleiben noch 5 |
| Elektronen der 3. Schale | 9 | max. 18 – erst jetzt wird in der 3. Schale „weitergebaut“ |
| Elektronen der 4. Schale | 2 | max. 32 |
So entsteht die Elektronenkonfiguration der Nebengruppenelemente.
Abschließende Bemerkungen / Ausblick

Das Bohrsche Atommodell ist leider noch nicht der Weisheit letzter Schluss. Auch dieses hat seine Schwächen. Der wichtigste Nachfolger ist das Orbitalmodell, wobei die Orbitale nur Aufenthaltswahrscheinlichkeiten für Elektronen darstellen. Es würde den Rahmen sprengen, hier näher darauf einzugehen.

